Химик.про
Содержание:
- Коррозия в неэлектролитных жидкостях
- Виды коррозии
- 4 Коротко о газовой и других видах коррозии
- Виды коррозии бетона
- Методы защиты металлов от коррозии
- Почему коррозия называется коррозией?
- Олово и цинк. «Опасные» и «безопасные покрытия
- Коррозия металлов
- Основные виды коррозии
- Примечания
- Коррозия некоторых металлов
- Газовая коррозия
Коррозия в неэлектролитных жидкостях
Общие сведения
К жидким неэлектропроводным средам (а точнее, неэлектролитным жидкостям) можно отнести такие органические вещества, к примеру:
- Керосин.
- Бензол.
- Бензин.
- Хлороформ.
- Нефть.
- Спирты.
- Фенол.
- Тетрахлорид углерода.
Еще к таким жидкостям причисляют малое количество жидкостей неорганического типа, к примеру, жидкий бром и сера, которая расплавлена. При этом следует отметить, что растворители органического типа сами по себе не будут вступать в реакцию с металлами, но, при наличие маленького объема примесей появляется интенсивный процесс взаимодействий. Скорость коррозии увеличивают находящиеся в нефти элементов с содержанием серы.
Также, для усиления коррозийных процессов нужны высокие температуры. Влага будет интенсифицировать развитие коррозии по электромеханическому принципу. Еще одним фактором быстрого коррозийного развития – бром в жидком виде. При нормальной температуре он особенно разрушительно будет воздействовать на высокоуглеродистые стали, титан и алюминий. Менее существенно воздействие брома на никель и железо, а самую большую устойчивость к жидкому типу брома будут показывать тантал, свинец, платина и серебро.
Расплавленная сера будет вступать в агрессивные реакции практически со всеми металлами, и в первую очередь с оловом, свинцом и медью. На углеродистые марки титан и стали сера будет влиять меньше, а еще практически полностью разрушает алюминий. Защитные действия для металлических конструкций, которые находятся в неэлектропроводных средах жидкого типа, проводят добавлением устойчивым к определенной среде металлом (к примеру, сталей с большим содержанием хрома). Еще используются особые защитные покрытия (к примеру, в среде, где есть много серы, применяют алюминиевые покрытия).
Способы защиты от коррозии
Способы борьбы с коррозией будут включать в себя:
- Обработку главного металла защитным слоем (например, нанесение лакокрасочного материала).
- Применение ингибиторов (арсенитов или хроматов).
- Внедрение материалов, которые устойчивые к коррозийным процессам.
Подбор определенного материала будет зависеть от потенциальной эффективности (тут имеется виде финансовой и технологической) ее применения.
Современные принципы по защите металла от химической коррозии металла будут основаны на следующих методиках:
- Улучшение споротивляемости химического типа. Себя смогли успешно зарекомендовать устойчивые материалы (стекло, высокополимерный пластик и керамика).
- Изоляция материала от агрессивных сред.
- Уменьшение агрессивности технологической среды – в роли примеров таких действий можно выполнить нейтрализацию и удалить кислотность в коррозионой среде, а еще применять различные ингибиторы.
- Защита электрохимического типа (накладывание внешнего тока).
Указанные методики будут подразделяться на две группы:
- Повышение сопротивляемости химического типа и изолирование будет применяться до того, как металлическая конструкция запускается в использовании.
- Уменьшение агрессивности и защиты электрохимического типа применяется уже при применении изделий и металла. Использование обеих методик дает возможность внедрять новые защитные методы, и в результате защита будет обеспечиваться изменением эксплуатационных условий.
Одним из самых часто используемых методов защиты металла является антикоррозийное гальваническое покрытие, но это экономически нерентабельно при большой площади поверхности. Причина в больших тратах на процесс подготовки. Ведущее место среди методов по защите будет занимать покрытие металла лакокрасочным материалом.
И все-таки, окрашенная поверхность защищает металлы от процессов коррозии даже при локальном повреждении пленки, тогда как несовершенные покрытия гальванического типы способны даже ускорить коррозию.
Виды коррозии
Как уже говорилось, критериев классификация коррозионных процессов существует множество. Так, различают коррозию по виду распространения (сплошная, местная), по типу коррозионной среды (газовая, атмосферная, жидкостная, почвенная), по характеру механических воздействий (коррозионное растрескивание, явление Фреттинга, кавитационная коррозия) и так далее.
Но основным способом классификации коррозии, позволяющим наиболее полно объяснить все тонкости этого процесса, является классификация по механизму протекания.
По этому критерию различают два вида коррозии:
- химическую
- электрохимическую
Химическая коррозия
Химическая коррозия отличается от электрохимической тем, что протекает в средах, не проводящих электрический ток. Поэтому при такой коррозии разрушение металла не сопровождается возникновением электрического тока в системе. Это обычное окислительно-восстановительное взаимодействие металла с окружающей средой.
Наиболее типичным примером химической коррозии является газовая коррозия. Газовую коррозию еще называют высокотемпературной, поскольку обычно она протекает при повышенных температурах, когда возможность конденсации влаги на поверхности металла полностью исключена. К такому виду коррозии можно отнести, например, коррозию элементов электронагревателей или сопел ракетных двигателей.
Скорость химической коррозии зависит от температуры — при ее повышении коррозия ускоряется. Из-за этого, например, в процессе производства металлического проката, во все стороны от раскаленной массы разлетаются огненные брызги. Это с поверхности металла скалываются частички окалины.
Окалина — типичный продукт химической коррозии, — оксид, возникающий в результате взаимодействия раскаленного металла с кислородом воздуха.
Помимо кислорода и другие газы могут обладать сильными агрессивными свойствами по отношению к металлам. К таким газам относятся диоксид серы, фтор, хлор, сероводород. Так, например, алюминий и его сплавы, а также стали с высоким содержанием хрома (нержавеющие стали) устойчивы в атмосфере, которая содержит в качестве основного агрессивного агента кислород. Но картина кардинально меняется, если в атмосфере присутствует хлор.
В документации к некоторым антикоррозионным препаратам химическую коррозию иногда называют «сухой», а электрохимическую — «мокрой». Однако химическая коррозия может протекать и в жидкостях. Только в отличие от электрохимической коррозии эти жидкости — неэлектролиты (т.е. не проводящие электрический ток, например спирт, бензол, бензин, керосин).
Примером такой коррозии является коррозия железных деталей двигателя автомобиля. Присутствующая в бензине в качестве примесей сера взаимодействует с поверхностью детали, образуя сульфид железа. Сульфид железа очень хрупок и легко отслаивается, освобождая свежую поверхность для дальнейшего взаимодействия с серой. И так, слой за слоем, деталь постепенно разрушается.
Электрохимическая коррозия
Если химическая коррозия представляет собой не что иное, как простое окисление металла, то электрохимическая — это разрушение за счет гальванических процессов.
В отличие от химической, электрохимическая коррозия протекает в средах с хорошей электропроводностью и сопровождается возникновением тока. Для «запуска» электрохимической коррозии необходимы два условия: гальваническая пара и электролит.
В роли электролита выступает влага на поверхности металла (конденсат, дождевая вода и т.д.). Что такое гальваническая пара? Чтобы понять это, вернемся к ряду активности металлов.
Смотрим. Cлева расположены более активные металлы, справа — менее активные.
Если в контакт вступают два металла с различной активностью, они образуют гальваническую пару, и в присутствии электролита между ними возникает поток электронов, перетекающих от анодных участков к катодным. При этом более активный металл, являющийся анодом гальванопары, начинает корродировать, в то время как менее активный коррозии не подвергается.
Схема гальванического элемента
Для наглядности рассмотрим несколько простых примеров.
Допустим, стальной болт закреплен медной гайкой. Что будет корродировать, железо или медь? Смотрим в ряд активности. Железо более активно (стоит левее), а значит именно оно будет разрушаться в месте соединения.
Стальной болт — медная гайка (корродирует сталь)
А если гайка алюминиевая? Снова смотрим в ряд активности. Здесь картина меняется: уже алюминий (Al), как более активный металл, будет терять электроны и разрушаться.
Таким образом, контакт более активного «левого» металла с менее активным «правым» усиливает коррозию первого.
4 Коротко о газовой и других видах коррозии
Газовая коррозия отмечается, как правило, при повышенных температурах в атмосфере сухих паров и газов. Больше всего от нее страдают предприятия химической, нефтегазовой и металлургической промышленности, так как она поражает емкости, где производится переработка химических соединений и веществ, двигатели специальных машин, химические установки и агрегаты, газовые турбины, оборудование для термообработки и плавления стали и металлов.
Протекает газовая коррозия при окислении:
- углекислого газа (углекислотная коррозия);
- сероводорода (сероводородная коррозия);
- водорода, хлора, различных галогенов, метана.
Наиболее часто газовая коррозия обусловлена воздействием кислорода. Разрушение металлов при ней идет по далее приведенной схеме:
- ионизация металлической поверхности (появляются электроны и катионы, которые насыщают оксидную пленку);
- диффузия (к газовой фазе) электронов и катионов;
- ослабление межатомных связей в кислородной молекуле, вызванное адсорбцией (физической) на металлической поверхности кислорода;
- адсорбция химического типа, приводящая к созданию плотной пленки оксидов.

После этого ионы кислорода проникают вглубь пленки, где они контактируют с катионами металла. Газовая коррозия, вызываемая влиянием других химических соединений, проходит по аналогичному принципу.
Явление водородной коррозии стали отмечается в технологическом оборудовании, которое работает в водородных атмосферах при высоких (от 300 МПа) давлениях и температурах более +200 °С. Такая коррозия образуется за счет контакта карбидов, входящих в стальные сплавы, с водородом. Визуально она плохо заметна (поверхность конструкции не имеет явных повреждений), но при этом прочностные показатели стальных изделий существенно уменьшаются.
Существует также понятие коррозии с водородной деполяризацией. Этот процесс может происходить при определенной величине парциального давления в среде, с которой контактирует электролит. Обычно явление коррозии с водородной деполяризацией наблюдается в двух случаях:
- при низкой активности в электролитическом растворе ионов металла;
- при повышенной активности в электролите ионов водорода.

Углекислотная коррозия поражает нефтяное оборудование и трубопроводы, которые функционируют в средах, содержащих двуокись углерода. В наши дни такой вид коррозионного разрушения предотвращают путем эксплуатации нержавеющих сталей с малым уровнем легирования. Оптимальные результаты, как показала практика, отмечаются при использовании сплавов с включением хрома от 8 до 13 процентов.
Виды коррозии бетона
Бетон является крепким каменным строительным материалом, состоящим из цемента, наполнителя и связующих веществ. Так как этот материал эксплуатируется в условиях открытой окружающей среды, а также нередко в агрессивно-опасных средах, то он так же подвержен коррозийному износу.

Схема коррозии на бетоне
Существует несколько видов бетонной коррозии:
- В результате взаимодействия с окружающей средой, на поверхности бетона могут образовываться легкорастворимые соли, которые при взаимодействии с внутренними компонентами материала приводят к его разрушению.
- Часто встречающаяся проблема – это разъединение составных частей цементного камня водой или вымывание гидроксида кальция, который образовывается в процессе такой реакции или ранее.
- В условиях окружающей среды, в состав бетона проникают вещества, которые имеют достаточно большой объем, в сравнении с исходными продуктами реакции, что приводит к механическим и химическим повреждениям целостности материала, далее эти участки под воздействием окружающей среды начинают коррозировать про принципу 1 или 2.
Методы защиты металлов от коррозии

Коррозия каждый приводит к тому, что появляется большое количество убытков. Они исчисляются миллионами. Ущерб наносится не потому, что коррозия уничтожает металлы, а потому что в результате этого процесса портятся вещи из металлических материалов. В мире применяется большое количество оборудования, которое в большинстве своем сделано из металлической основы. Его стоимость является достаточно высокой. После выхода из строя оборудования не каждая организации имеет возможность приобрести еще одно такого же уровня. Именно поэтому так необходима защита от коррозии.
В современном мире очень важно правильно подобрать средства для борьбы с появлением ржавчины на металлических изделиях. Необходимо перед нанесением краски тщательно подготовить металлическую поверхность
От этого зависит восемьдесят процентов противостояния образованию коррозии. Лакокрасочные материалы, которые наносятся в последующем, обеспечивают лишь двадцати процентную защиту. Сегодня для обработки металлических поверхностей можно использовать специальные преобразователи ржавчины, которые выполняют роль и защиты и грунтовки.
Почему коррозия называется коррозией?
Слово коррозия происходит от латинского «corrodo» – «грызу». Некоторые источники ссылаются на позднелатинское «corrosio» – «разъедание». Не следует путать понятия «коррозия» и «ржавчина». Если коррозия – это процесс, то ржавчина один из его результатов. Это слово применимо только к железу, входящему в состав стали и чугуна. В дальнейшем под термином «коррозия» мы будем подразумевать коррозию металлов. Согласно международному стандарту ISO 8044 под коррозией понимают физико-химическое или химическое взаимодействие между металлом (сплавом) и средой, приводящее к ухудшению функциональных свойств металла (сплава), среды или включающей их технической системы. РЖАВЧИНА – это слой частично гидратированных оксидов железа, образующийся на поверхности железа и некоторых его сплавов в результате коррозии. Коррозионному разрушению подвержены также бетон, строительный камень, дерево, другие материалы; коррозия полимеров называется деструкцией.
Среда, в которой металл подвергается коррозии (корродирует) называется коррозионной или агрессивной средой. В случае с металлами, говоря об их коррозии, имеют ввиду нежелательный процесс взаимодействия металла со средой.
Физико-химическая сущность изменений, которые претерпевает металл при коррозии, является окисление металла. Любой коррозионный процесс является многостадийным:
- Необходим подвод коррозионной среды или отдельных ее компонентов к поверхности металла.
- Взаимодействие среды с металлом.
- Полный или частичный отвод продуктов от поверхности металла (в объем жидкости, если среда жидкая).
Известно, что большинство металлов (кроме Ag, Pt ,Cu, Au) встречаются в природе в ионном состоянии: оксиды, сульфиды, карбонаты и др., называемые обычно рудами металлов. Ионное состояние более выгодно, оно характеризуется меньшей внутренней энергией. Это заметно при получении металлов из руд и их коррозии. Поглощенная энергия при восстановлении металла из соединений свидетельствует о том, что свободный металл обладает более высокой энергией, чем металлическое соединение. Это приводит к тому, что металл, находящийся в контакте с коррозионно-активной средой стремится перейти в энергетически выгодное состояние с меньшим запасом энергии. То есть можно сказать, что первопричиной коррозии является термодинамическая неустойчивость системы, состоящей из металла и компонентов окружающей (коррозионной) среды. Мерой термодинамической неустойчивости является свободная энергия, освобождаемая при взаимодействии металла с этими компонентами. Но свободная энергия сама по себе ещё не определяет скорость коррозионного процесса, т. е. величину, наиболее важную для оценки коррозионной стойкости металла. В ряде случаев адсорбционные или фазовые слои (плёнки), возникающие на поверхности металла в результате начавшегося коррозионного процесса образуют настолько плотный и непроницаемый барьер, что коррозия прекращается или очень сильно тормозится. Поэтому в условиях эксплуатации металл, обладающий большим сродством к кислороду, может оказаться не менее, а более стойким (так, свободная энергия образования окисла у Cr или Al выше, чем у Fe, а по стойкости они часто превосходят Fe).
Олово и цинк. «Опасные» и «безопасные покрытия
Возьмем еще пример. Допустим, кузовная панель покрыта оловом. Олово — очень стойкий к коррозии металл, кроме того, оно создает пассивный защитный слой, ограждая железо от взаимодействия с внешней средой. Значит, железо под слоем олова находится в целости и сохранности? Да, но только до тех пор, пока слой олова не получит повреждение.
А когда такое случается, между оловом и железом тут же возникает гальваническая пара, и железо, являющееся более активным металлом, под воздействием гальванического тока начнет корродировать.
Кстати, в народе до сих пор ходят легенды о якобы «вечных» луженых кузовах «Победы». Корни этой легенды таковы: ремонтируя аварийные машины, мастера использовали паяльные лампы для нагрева. И вдруг, ни с того ни с сего, из-под пламени горелки начинает «рекой» литься олово! Отсюда и пошла молва, что кузов «Победы» был полностью облужен.
На самом деле все гораздо прозаичнее. Штамповая оснастка тех лет была несовершенной, поэтому поверхности деталей получались неровными. Вдобавок тогдашние стали не годились для глубокой вытяжки, и образование морщин при штамповке стало обычным делом. Сваренный, но еще не окрашенный кузов приходилось долго готовить. Выпуклости сглаживали наждачными кругами, а вмятины заполняли оловяным припоем, особенно много которого было вблизи рамки ветрового стекла. Только и всего.
Ну, а так ли «вечен» луженый кузов, вы уже знаете: он вечен до первого хорошего удара острым камешком. А их на наших дорогах более чем достаточно.
А вот с цинком картина совсем другая. Здесь, можно сказать, мы бьем электрохимическую коррозию ее же оружием. Защищающий металл (цинк) в ряду напряжений стоит левее железа. А значит при повреждении будет разрушаться уже не сталь, а цинк. И только после того, как прокорродирует весь цинк, начнет разрушаться железо. Но, к счастью, корродирует он очень и очень медленно, сохраняя сталь на долгие годы.
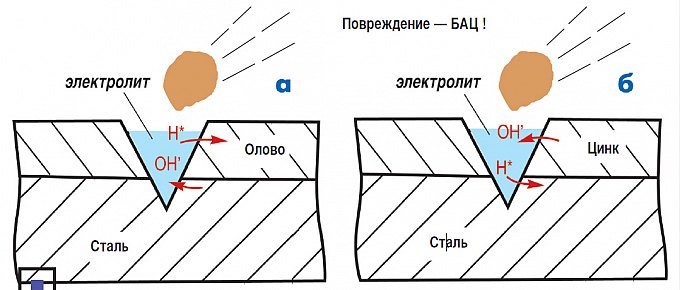 а) Коррозия луженой стали: при повреждении покрытия разрушается сталь. б) Коррозия оцинкованной стали: при повреждении покрытия разрушается цинк, защищая от коррозии сталь.
а) Коррозия луженой стали: при повреждении покрытия разрушается сталь. б) Коррозия оцинкованной стали: при повреждении покрытия разрушается цинк, защищая от коррозии сталь.
Покрытия, выполненные из более активных металлов называются «безопасными«, а из менее активных — «опасными«. Безопасные покрытия, в частности оцинковка, давно и успешно применяются как способ защиты от коррозии автомобильных кузовов.
Почему именно цинк? Ведь помимо цинка в ряду активности относительно железа более активными являются еще несколько элементов. Здесь подвох вот в чем: чем дальше в ряду активности находятся друг от друга два металла, тем быстрее разрушение более активного (менее благородного). А это, соответственно, сокращает долговечность антикоррозионной защиты
Так что для автомобильных кузовов, где помимо хорошей защиты металла важно достичь и продолжительного срока действия этой защиты, оцинковка подходит как нельзя лучше. Тем более, что цинк доступен и недорог
Кстати, а что будет, если покрыть кузов, например, золотом? Во-первых, будет ох как дорого! Но даже если золото стало бы самым дешевым металлом, такого делать нельзя, поскольку оно окажет нашей «железке» плохую услугу.
Золото ведь стоит очень далеко от железа в ряду активности (дальше всего), и при малейшей царапине железо вскоре превратится в груду ржавчины, покрытую золотой пленкой.
Автомобильный кузов подвергается воздействию как химической, так электрохимической коррозии. Но главная роль все же отводится электрохимическим процессам.
Ведь, чего греха таить, гальванических пар в автомобильном кузове много: это и сварные швы, и контакты разнородных металлов, и посторонние включения в листовом прокате. Не хватает только электролита, чтобы «включить» эти гальванические элементы.
А электролит тоже найти легко — хотя бы влага, содержащаяся в атмосфере.
Кроме того, в реальных условиях эксплуатации оба вида коррозии усиливаются множеством других факторов. Поговорим о главных из них поподробнее.
Коррозия металлов
При металлизации на поверхность направляется ионизированный дуговой поток мелкодисперсного напыляемого металла, а легирование реализуется в процессе выплавки металла, как следствие протекания металлургических реакций между основным металлом и вводимыми легирующими добавками.
В некоторых случаях существенного снижения коррозии удаётся добиться изменением состава атмосферы, в которой работает защищаемая металлоконструкция.
Это может быть вакуумирование для сравнительно небольших объектов , или работа в среде инертных газов аргон, неон, ксенон. Данный метод весьма эффективен, однако требует дополнительного оборудования — защитных камер, костюмов для обслуживающего персонала и т. Используется он главным образом, в научно-исследовательских лабораториях и опытных производствах, где специально поддерживается необходимый микроклимат.
Новое на сайте
В завершение укажем и на довольно необычный способ коррозионной защиты: с помощью самих окислов железа, точнее, одного из них — закиси-окиси Fe3O4. Данное вещество образуется при температурах …С и по своим механическим свойствам представляет собой высоковязкую технологическую смазку.
Это явление используется при скоростной высадке труднодеформируемых металлов и сплавов. Эффективность данного способа обусловлена тем, что при каждом технологическом цикле контактные поверхности обновляются, а потому стабильность процесса регулируется автоматически. Что такое коррозия и её разновидности Основной причиной интенсивного окисления поверхности металлов что и является основной причиной коррозии являются: Повышенная влажность окружающей среды.
Химическая коррозия
Наличие блуждающих токов. Неблагоприятный состав атмосферы. Схема работы Оставляете заявку на сайте или по телефону. Оцениваем запрос и тех.
Основные виды коррозии
Коррозионные процессы классифицируют по нескольким параметрам, а конкретные типы коррозии различают по некоторым признакам. Ниже вы узнаете, по каким факторам классифицируют коррозию, и что такое, например, химическая коррозия.
Классификация по механизму протекания процессов
Химическая коррозия – процесс контакта элемента металла со средой, способствующей развитию коррозии, во время которого реакция окисления металлического элемента и восстановления самой окислительной компоненты среды происходит одновременно.
Электрохимическая коррозия – механизм реакционного соприкосновения раствора электролита с металлом, сущность которого, в противовес химическому типу ржавления, заключается в процессе, когда атомы металла ионизируются, окислительная компонента среды восстанавливается не в едином пространственном и временном промежутке: скорость реакций обусловлена электродным потенциалом.
Классификация по виду коррозионной среды и условиям
Газовая коррозия – реакция ржавления металлов в условиях газовой среды с минимально допустимым содержанием воды (коэффициент не выше 0,1%) либо с применением экстремально высоких температур. Газовая коррозия популярна в промышленных сферах: нефтехимической, а также химической отраслях.
Подземная коррозия – ржавление в грунтовой среде.
Атмосферная коррозия — ржавление металлов в воздухе либо влажном газе.
Биокоррозия – реакция с появлением ржи под воздействием микроорганизмов.
Контактная коррозия – при подобной реакции участвует несколько металлов с отличными друг от друга потенциалами по электролиту.
Радиационная коррозия – возникновение ржи под влиянием радиоактивных лучей.
Коррозия током – процесс коррозии происходит в условиях воздействия внешнего либо блуждающего тока.
Коррозия под напряжением – ржавление металла в коррозионной среде под механическим напряжением. Химия подобного вида ржи небезопасна, в главной мере для опорных конструкций с воздействием механических нагрузок на них (турбины, рессоры, ведущие оси строений). Немаловажным нюансом при обозначенном типе ржавления служит потенциальная коррозионная усталость – накопительный эффект возникает при периодичном растягивающем напряжении.
Коррозионная кавитация – разрушительное влияние на металл коррозионной среды и ударной силы.
Фреттинг-коррозия – разрушение металлических поверхностей единовременным воздействием благоприятной для ржи среди и вибрации. По проявлению результатов процесса ликвидировать следствие возможно, для этого потребуется четко подобрать структурный материал, снизить уровень трения, применить покрывающую пленку либо выполнить другие подходящие в таком случае действия.
Межкристаллитная коррозия – проявление ржи по граням вкраплений. Так называемое скрытный разлом, в период активности которого внешних признаков не заметно, однако металл в краткие сроки лишается свойств прочности и эластичности. Наиболее часто от подобного вида внешнего вмешательства страдают сплавы, в состав которых входят никель, алюминий, хром.
Щелевая коррозия – является причиной повреждения металла в резьбовых креплениях, между прокладками и аналогичных участках.
На видео: всё о электрохимической коррозии.
Классификация по типу коррозионной деструкции
Сплошная коррозия – ржавчине подвергается поверхность целиком. Различают несколько подтипов:
- Равномерная (поверхностная коррозия) – ржа проявляется одновременно по захваченной процессом территории. Пример – разрушение железных труб на открытом воздухе.
- Неравномерная – скорость реакций на отдельных участках общей территории варьируется.
Избирательная коррозия — ржавеет один из компонентов сплавов или обособленная структурная секция (например, реакция обесцинкования латуни).
Местная коррозия — разрушению подвергаются сепаратные пятна целостного объекта. Проявление наблюдается в форме отдельных вкраплений поврежденностей, проникнувших на малую глубину слоя металла (ржа по латуни в соленой морской воде); значительных углублений в виде раковин (сталь, закопанная в почву); обособленных точек, именуемых питтингами, входящих в толщу металла на серьезную глубину (хромовоникелевая сталь аустенитного класса).
Примечания
- Антикоррозионная защита / Козлов Д.Ю.. — Екатеринбург: ООО «ИД «Оригами», 2013. — С. 343. — 440 с. — 1000 экз. — ISBN 978-5-904137-05-2.
- «ГОСТ 5272-68: Коррозия металлов. Термины.»
- Спиридонов А. А. В служеньи ремеслу и музам. — 2-е изд. — М.: Металлургия, 1989. — С. 53. — (Научно-популярная библиотека школьника). — 50 000 экз. — ISBN 5-229-00355-3.
- Merchant and Navy Ship events (1946—2000) — 25/12 1967
- См. также, например, газеты «Ogden Standard Examiner», «Bridgeport Post» за 24 декабря 1967 года.
- ISO 8501-1. «Подготовка стальной основы перед нанесением красок и подобных покрытий. Визуальная оценка чистоты поверхности Часть 1. Степени окисления и степени подготовки непокрытой стальной основы и стальной основы после полного удаления прежних покрытий.»
- Газотермическое напыление
- ГОСТ Р 9.316-2006 «Единая система защиты от коррозии и старения. Покрытия термодиффузионные цинковые. Общие требования и методы контроля.
- Доклад на 16-м Всемирном конгрессе по коррозии в Пекине, сентябрь 2005 года.
- «Руководство для подготовки инспекторов по визуальному и измерительному контролю качества окрасочных работ» — Екатеринбург: ООО «ИД «Оригами», 2009—202 с., ISBN 978-5-9901098-1-5
- «Part Of Bridge On Route I-95 Falls Into River In Greenwich,; Killing 3.». New York Times. June 29, 1983. (англ.)
- (Июнь 2008) «ИЗ ИСТОРИИ КОРРОЗИИ». журнал «Очистка. Окраска»№ 4 (15) : 48. Проверено 2010-10-03.
Коррозия некоторых металлов
Коррозия меди
Одним из ключевых химических элементов для отечественной промышленности является медь. Металл также подвержен деструкции, как и другие металлические поверхности, хотя медь больше защищена от коррозии.
Даже столь стойкий к разрушениям элемент подвержен негативным изменениям при воздействии окружающей среды. Коррозия меди имеет высокий показатель ухудшения свойств металла в аэрированных растворах, содержащих ионы, образовывающие комплексы с красным металлом, окислительных кислотах.
Медь стабильна в следующих условиях:
- в атмосферной среде;
- в морской и пресной водах;
- контактируя с галогенами в специальных условиях;
- в кислотах-неокислителях, слабых растворах Н3РО4, Н2SO4.
Медь нестабильна в следующих условиях:
- в ряде соединений серы, в том числе сероводороде, чистой сере;
- в кислотах-окислителях, аэрированной неокислительной среде, концентрате Н2SO4, например:
- растворах солей-окислителей тяжелых металлов, как то Fe2(SO4)3, FeCl3;
- агрессивной воды, аэрированной воды;
- амина, NH4OH.
2Cu+H2O+CO2+O2→ CuCO3*Cu(OH)2
Коррозия железа
Еще один распространенный элемент, подверженный ржавлению от коррозии – железо. Наибольший процент реакций по возникновению ржи на железе припадает на реакции по его окислению воздухом или кислотами из растворов.
При химической коррозии электроны переходят на окислитель, окисление металлов показано наглядно:
3Fe+2O2→Fe3O4
Электрохимическая коррозия протекает в условиях токовой проводимости. Пример атмосферной и грунтовой реакции:
Fe+O2+H2O→Fe2O3∙xH2O
Газовая коррозия
Самая частая разновидность химической коррозии — газовая — представляет собой коррозийный процесс, происходящий в газах при повышенных температурах. Указанная проблема характерна для работы многих типов технологического оборудования и деталей (арматуры печей, двигателей, турбин и т.д.). Кроме того, сверхвысокие температуры используются при обработке металлов под высоким давлением (нагревание перед прокаткой, штамповкой, ковкой, термическими процессами и т.д.).
Особенности состояния металлов при повышенных температурах обуславливаются двумя их свойствами — жаропрочностью и жаростойкостью. Жаропрочность — это степень устойчивости механических свойств металла при сверхвысоких температурах. Под устойчивостью механических свойств понимается сохранение прочности в течение продолжительного времени и сопротивляемость ползучести. Жаростойкость — это устойчивость металла к коррозионной активности газов в условиях повышенных температур.

Скорость развития газовой коррозии обуславливается рядом показателей, в числе которых:
- температура атмосферы,
- компоненты, входящие в металл или сплав,
- параметры среды, где находятся газы,
- продолжительность контактирования с газовой средой,
- свойства коррозийных продуктов.
На коррозийный процесс больше влияние оказывают свойства и параметры оксидной пленки, появившейся на металлической поверхности. Образование окисла можно хронологически разделить на два этапа:
- адсорбция кислородных молекул на металлической поверхности, взаимодействующей с атмосферой,
- контактирование металлической поверхности с газом, в результате чего возникает химическое соединение.

Первый этап характеризуется появлением ионной связи, как следствие взаимодействия кислорода и поверхностных атомов, когда кислородный атом отбирает пару электроном у металла. Возникшая связь отличается исключительной силой — она больше, нежели связь кислорода с металлом в окисле.
Объяснение такой связи кроется в действии атомного поля на кислород. Как только поверхность металла наполняется окислителем (а это происходит очень быстро), в условиях низких температур, благодаря силе Ван-дер-Ваальса, начинается адсорбция окислительных молекул. Результат реакции — возникновение тончайшей мономолекулярной пленки, которая с течением времени становится толще, что усложняет доступ кислорода.
На втором этапе происходит химическая реакция, в ходе которой окислительный элемент среды отбирает у металла валентные электроны. Химическая коррозия — конечный результат реакции.
Указанные выше методики подразделяются на две группы:
- Повышение химической сопротивляемости и изолирование применяются до того, как металлоконструкция запускается в эксплуатацию.
- Уменьшение агрессивности среды и электрохимическая защита используются уже в процессе применения изделия из металла. Применение этих двух методик дает возможность внедрять новые способы защиты, в результате которых защита обеспечивается изменением эксплуатационных условий.
Один из самых часто применяемых способов защиты металла — гальваническое антикоррозийное покрытие — экономически нерентабелен при значительных площадях поверхностей. Причина в высоких затратах на подготовительный процесс.

Ведущее место среди способов защиты занимает покрытие металлов лакокрасочными материалами. Популярность такого метода борьбы с коррозией обусловлена совокупностью нескольких факторов:
- высокие защитные свойства (гидрофобность, отталкивание жидкостей, невысокие газопроницаемость и паропроницаемость),
- технологичность,
- широкие возможности для декоративных решений,
- ремонтопригодность,
- экономическая оправданность.
В то же время, использование широкодоступных материалов не лишено недостатков:
- неполное увлажнение металлической поверхности,
- нарушенное сцепление покрытия с основным металлом, что ведет к скапливанию электролита под антикоррозийным покрытием и, таким образом, способствует коррозии,
- пористость, приводящая к повышенной влагопроницаемости.
И все же, окрашенная поверхность защищает металл от коррозийных процессов даже при фрагментарном повреждении пленки, тогда как несовершенные гальванические покрытия способны даже ускорять коррозию.

















